新闻动态NEWS
您现在所在的位置: 首页» 新闻动态 News祝贺实验室多位同学获得2019-2020年研究生奖励奖学金
2020.10.21根据学校《关于2019-2020学年北京大学学生奖励评选工作的通知》、《关于2019-2020学年奖学金评审工作安排的通知》,经过个人申请、班级民主素质测评、导师推荐、学院审核等程序,本实验室岳頔同学获得2019-2020学年三好学生和研究生专项奖学金,王春慧和张心怡同学获得单项奖学金,伊宗裔同学获得学习优秀奖。
向几位同学表示热烈祝贺!
祝贺曹中正、陈一欧、刘志恒和璩良四位同学顺利获得博士学位
2020.07.17祝贺本课题组曹中正、陈一欧、刘志恒和璩良四位同学顺利通过学位答辩,取得博士学位!
希望各位同学今后张开翱翔的翅膀,追逐理想;荡起快乐的双桨,迎接希望。带着理想,举起希望,携着坚强,勇敢前往通向成功的大道上!愿心如所想!


祝贺本课题组张心怡同学获得2020-2021学年校长奖学金
2020.07.15经过生命科学学院组织的答辩和评审工作,本实验室2016级博士研究生张心怡同学获得了2020-2021年度校长奖学金。
北京大学“校长奖学金”是学校设立的资助额度最大、影响范围最广,同时也是师生最关切、竞争最激烈的学术荣誉称号。申请者除了德智体美劳全面发展以外,还需要满足以下三个条件:第一,攻读博士研究生期间发表过较高水平的学术论文或论著等;第二,参加过国家重大课题研究并取得阶段性成果;第三,上一学年度专业成绩排名在前5%。获奖同学在课程学习、学术研究等方面均有突出表现,相信在今后的学习和科研中,将更好的发挥示范带动作用,鼓励本实验室的同学们更加专注学业精进,实现品学兼优、全面发展。
本课题组与合作单位报导COVID-19患者呼吸道天然免疫特征
2020.06.112020年5月4日,本课题组与中国医学科学院病原生物学研究所,中科院北京基因组所在Cell Host & Microbe 杂志合作发表题为“Heightened innate immune responses in the respiratory tract of COVID-19 patients”的研究论文(当期封面文章)。

由SARS-CoV-2感染引起的2019年新型冠状病毒疾病(COVID-19)爆发对全球公共卫生构成了严重威胁。感染患者经常具有强烈的炎症反应,这种免疫失调,称为“细胞因子风暴”。 为了深入研究COVID-19患者的免疫特征,研究人员采集了肺泡灌洗液标本(BALF),其中8个样品来自COVID-19患者,146个样品来自社区性肺炎(CAP),20个样品来自健康人群(对照组)。通过宏转录组测序对BALF中的宿主转录组和病原体进行测序发现,SARS-COV-2样本中的差异表达基因数量明显高于病毒样CAP样本和非病毒样CAP样本,这表明SARS-CoV-2感染强烈干扰肺细胞的转录组稳态。
深入分析表明,COVID-19患者的呼吸道细胞中表现出了以趋化因子CXCL8、CCL2、CCL7等为主导的高细胞因子症状,提示患者肺部中的中性粒细胞和单核细胞的大量浸润。动态观察结果显示,随着时间推移,细胞因子表达水平逐渐降低,表明了COVID-19中的过度的炎症可以逐步得到解决,而持续发生的炎症可能产生不良后果。另外,与被认为诱导干扰素(IFN)反应不足的SARS-CoV相比,SARS-CoV-2强烈触发了许多IFN诱导型基因(ISG)的表达。与其它病毒如Dengue病毒、HCV的感染引起的ISG不同,SARS-CoV-2感染诱导的众多ISG除了具有抗病毒效应,还可能具有显著促炎反应的特征。这个结果提示,干扰素治疗需要在适当的时机进行,如果COVID-19患者已经产生了高细胞因子症状,干扰素治疗可能会加重免疫病理反应。该项研究揭示了COVID-19患者呼吸道的天然免疫特征,为深入理解SARS-CoV-2的致病机制和临床用药提供了依据。
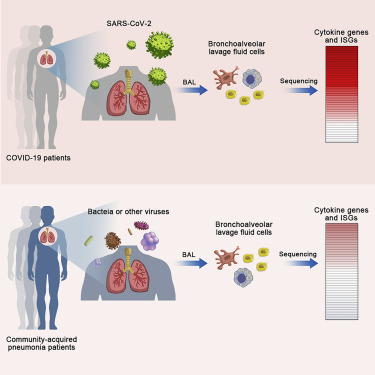
本课题组周卓副研究员、中国医学科学院病原生物学研究所任丽丽研究员、中科院北京基因组所张莉博士、钟嘉鑫、以及中国医学科学院病原生物学研究所肖艳为本文的共同第一作者。中国医学科学院病原生物学研究所王健伟教授和中科院北京基因组所李明锟研究员为本文的共同通讯作者。该研究项目得到了传染病防治国家科技重大专项、中国医学科学院创新工程、国家自然科学基金、国家重点研发计划、中国科学院战略性先导科技专项、北京未来基因诊断高精尖创新中心等基金支持。
本课题组博士生璩良获得2020年全国博士后创新人才资助
2020.06.116月10日全国博士后管委会办公室和中国博士后科学基金会公示了2020年度“博士后创新人才支持计划”拟资助人选名单,本课题组博士生璩良入选。
博士后创新人才支持计划是人力资源和社会保障部、全国博士后管委会新设立的一项青年拔尖人才支持计划,旨在加速培养造就一批进入世界科技前沿的优秀青年科技创新人才,是我国培养高层次创新型青年拔尖人才的又一重要举措。2020年博士后创新人才拟资助人选共有400人,人选主要来自全国各大高校、中国科学院、军队系统等博士后设站单位。
博士后创新人才计划的待遇优厚,遴选严格。资助每人每年30万元,两年60万元,其中40万元为博士后日常经费,20万元为博士后科学基金。本次计划共有63个学科获资助,多数为基础学科,相比2019年增加3个学科。其中生物学入选人数最多,共有34人,比去年增加2人。其次是材料科学与工程,入选人数30人,化学共有28人入选。临床医学、物理学也都有20人以上入选,其余学科入选人数都在20人以下。
本课题组博士生璩良获2020年度吴瑞奖
2020.06.032020年度吴瑞奖获奖名单揭晓,北京大学生物医学前沿创新中心(BIOPIC)、北京大学生命科学学院魏文胜课题组博士生璩良获得殊荣。
被誉为华人生命科学领域在读博士最高奖项的吴瑞奖,由吴瑞纪念基金会(RWMF)于2008年设立,并于2009年首次颁发。吴瑞奖学金旨在鼓励生命科学领域的博士研究生努力将自己塑造成为未来生命科学领域的学术带头人,同时也纪念吴瑞教授在培养中国新一代生命科学研究领域杰出人才所做出的杰出贡献。在中国大陆、香港、澳门、台湾及新加坡的大学或研究所攻读博士学位的在读学生均可提出申请。吴瑞奖学金奖励从事生命科学领域的、有创新性、独立思考能力和专注奉献精神的博士研究生,该奖项每年颁发约十人次。
璩良于2015年在苏州大学医学部获学士学位,同年加入北京大学魏文胜课题组攻读博士学位(PTN项目),博士期间主要致力于新型基因编辑技术的开发及基因治疗应用研究。2019年,璩良与课题组其它成员合作开发了一种全新的RNA单碱基编辑技术—LEAPER(Leveraging Endogenous ADAR for Programmable Editing of RNA),该项研究摆脱了CRISPR/Cas系统中对外源蛋白的依赖,利用细胞内源编辑机制实现了精准的基因编辑,具有高精准、无免疫原性、容易递送、安全长效等诸多优势。研究成果以Article形式发表在Nature Biotechnology杂志。
本课题组报道单氨基酸精度绘制蛋白质功能图谱新方法
2019.12.182019年12月16日,本课题组在Genome Biology杂志在线发表题为“PASTMUS: mapping functional elements at single amino acid resolution in human cells”的研究论文。
精准绘制蛋白质功能图谱对于研究蛋白质的作用机制十分重要。传统方法通常需要构建蛋白质的截短突变,工作量巨大且效率低下。近年来一些高通量手段比如利用错义突变进行文库筛选、利用CRISPR-Cas系统产生覆瓦式(tiling)突变并结合sgRNA富集分析等被用于相关研究,但这些方法受限于覆盖程度及位点精度,而且均不适用于隐性遗传突变类型。
本课题组开发了名为PASTMUS(PArsing fragmented DNA Sequences from CRISPR Tiling MUtagenesis Screening)的新方法(图1)。通过CRISPR-Cas介导的覆瓦式突变首先对目标基因产生覆盖度高、种类丰富的突变体文库,结合功能性筛选和对目标基因碎片化后深度测序,再利用全新的生物信息学分析方法对数据进行多重过滤,最终实现了对蛋白质功能相关位点的精确定位。该论文分别对三种毒素受体蛋白和三种抗癌药物靶标蛋白进行了功能性扫描,实现了单氨基酸精度的蛋白功能图谱绘制。除此以外,PASTMUS方法还可以广泛应用于非编码RNA、启动子、增强子等调控性元件的研究,也可以演变为蛋白进化的高效手段。
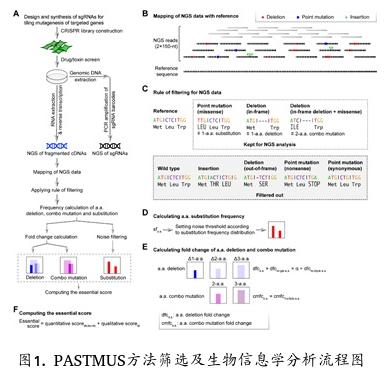
本课题组博士生张心怡、岳頔、博士后刘莹以及已经毕业的王轶楠博士、周悦欣博士为该论文共同第一作者。该研究项目得到了国家自然科学基金重点、面上及青年项目、北京市科委生命科学前沿创新培育项目、北京未来基因诊断高精尖创新中心、北大-清华生命科学联合中心以及传染病防治国家科技重大专项的基金支持。
文章链接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-019-1897-7
祝贺朱诗优博士入选《麻省理工科技评论》2019年度中国“35岁以下科技创新35人”获奖名单
2019.12.16今年是《麻省理工科技评论》创刊120周年,第三届“35岁以下科技创新35人”中国榜单在2019年12月14日的EmTech China全球新兴科技峰会揭晓。本实验室的博士后朱诗优同学荣获“先锋者”荣誉,获奖理由是他建立和优化基因组高通量功能性筛选方法学,实现安全高效的 RNA 单碱基编辑。
从1999年开始,每一年《麻省理工科技评论》都会选出一批35岁以下最具有创新性与影响力的科学家、科研工作者、科技创业者。在历年的获奖榜单上,有许多在具有产业化潜能的领域方面坚持科研使命的获奖人,也有海外顶尖学术机构的科学家们,这其中有超过半数以上的获奖者,都取得了世界级的突破性研究成果与发现。
朱诗优博士在本实验室的研究课题聚焦于基于 CRISPR-Cas9 系统的基因敲除的高通量功能性筛选方法学的建立和优化,首次建立了在哺乳动物细胞中的基因敲除功能性筛选,该遗传学工具彻底改变了研究基因功能的方式,并建立了首次报道实现的对于非编码 RNA 等基因组非编码元件的功能性敲除筛选方法学。
此外,朱诗优博士与课题组的同事研究建立了全新的 RNA 编辑方法——LEAPER 系统,首次实现不依赖任何外源蛋白表达的核酸精准高效编辑,展现出 LEAPER 在基因修复和疾病治疗领域的巨大潜力。

魏文胜教授获得2019年度北京市留学人员创新创业特别贡献奖
2019.12.16魏文胜教授获得2019年度北京市留学人员创新创业特别贡献奖。
“北京市留学人员创新创业特别贡献奖”是经中央批准保留,以市政府名义开展的市级表彰奖项,面向创新成果丰富或创业示范效应显著的留学归国人员。
祝贺实验室多位同学获得2018-2019学年奖学金和三好学生荣誉奖励
2019.10.22根据生命科学学院与前沿交叉研究院的综合评审,经过学生答辩等环节,本实验室有多位学生获得了2018-2019学年度研究生奖学金和三好学生等荣誉奖励,名单如下:
| 廖凯原奖学金 | 伊宗裔 |
| 五四奖学金 | 曹中正 |
| 方正奖学金 | 刘志恒 |
| 学习优秀奖 | 拉毛切忠 |
| 中国石油奖学金 | 王春慧 |
| 海亮奖学金 | 田峰 |
| 北京大学三等奖学金 | 潘倩 |
| 研究生专项学业奖学金 | 何苑 |
| 单项奖 | 田峰 张心怡 |
| 三好学生标兵 | 璩良 |
| 三好学生 | 刘志恒 曹中正 伊宗裔 何苑 潘倩 王春慧 |
向这些获奖同学表示祝贺!
祝贺刘志恒同学获得2018-2019年度校长奖学金
2019.10.10经过生命科学联合中心组织的答辩和评审工作,本实验室生命科学联合中心2015级博士研究生,刘志恒同学获得了2018-2019年度校长奖学金。
祝贺璩良同学荣获2018-2019学年度国家奖学金
2019.10.07根据校发《关于2018-2019学年国家奖学金评审工作安排的通知》,经过申请、班级民主素质测评、学院审核、候选人答辩等程序,本实验室璩良同学获得了生命科学学院2018-2019年度博士研究生“国家奖学金”。向璩良同学表示热烈的祝贺!
璩良同学不仅学习成绩优异,而且在科研上也不断努力与创新。在与同组同学的合作下,于2019年7月在Nature Biotechnology杂志发表了题为“Programmable RNA editing by recruiting endogenous ADAR using engineered RNAs”的研究论文,首次报道名为LEAPER的新型RNA单碱基编辑技术。
魏文胜教授获得2019勃林格殷格翰研究员奖
2019.09.252019年9月23日,“勃林格殷格翰研究员奖及博士后基金奖颁奖仪式暨第三届北京大学-勃林格殷格翰生物医学研究联合论坛” 在北京大学隆重举行。魏文胜教授获得2019勃林格殷格翰研究员奖。
2017年,北京大学和勃林格殷格翰公司签署协议,建立战略伙伴关系合作,旨在共同推动早期科学创新,以填补肿瘤、肿瘤免疫和免疫调节、呼吸系统、心血管和代谢系统、中枢神经系统疾病等以及新兴领域的医疗需求。该战略伙伴合作关系包含多种合作形式,包括以具体科研项目为基础的共同研究、博士后奖学金及研究员奖、系列药物研发讲座等。
魏老师荣获北京大学生命科学学院2018年度未名杰出科研奖
2019.09.06魏老师荣获北京大学生命科学学院2018年度未名杰出科研奖。
未名杰出科研奖基金由北京北大未名生物工程集团董事长、生命科学学院1989研究生潘爱华校友于2014年出资设立,用于表彰在科学研究中取得系列原创性成果、为生命科学学院的科研发展做出突出贡献的教师。
本课题组发展的新型基因编辑技术被Nature Reviews系列杂志报道
2019.08.14近日,国际著名评论型综述杂志: Nature Reviews Genetics与Nature Reviews Drug Discovery均在研究亮点(Research Highlight)专栏中对本课题组发表的题为 “Programmable RNA editing by recruiting endogenous ADAR using engineered RNAs”的论文进行了报道与评述,全文链接如下:
魏文胜教授在NHK电视台参加基因编辑技术专题讨论
2019.08.142019年3月,魏文胜教授参加了在日本NHK电视台举行的题为“Genome Science Editing Humanity’s Future”的专题讨论,与京都大学的山中伸弥(Shinya Yamanaka)教授(诺贝尔奖获得者)、UCSF的Bruce Conklin教授以及大阪大学的加藤和人(Kazuto Kato)教授等就基因编辑发展现状、前景、挑战及伦理问题等进行了深入讨论。

本课题组报道新型基因编辑技术
2019.07.162019年7月15日,本课题组以长文形式在Nature Biotechnology杂志在线发表了题为 “Programmable RNA editing by recruiting endogenous ADAR using engineered RNAs” 的研究论文,首次报道了名为LEAPER的新型RNA 单碱基编辑技术。与传统的核酸编辑技术需要向细胞同时递送编辑酶(如Cas蛋白)及向导RNA不同,LEAPER系统仅需要在细胞中表达向导RNA即可招募细胞内源脱氨酶实现靶向目标RNA的编辑。利用该技术,研究人员在一系列疾病相关基因转录本中实现了高效、精准的编辑,并成功修复了来源于Hurler综合征病人的α-L-艾杜糖醛酸酶缺陷细胞。该技术的建立为生命科学基础研究和疾病治疗提供了一种全新的工具。
近年来,以CRISPR/Cas9为代表的基因组编辑技术在生物医学等诸多领域产生了深远的影响,但该技术目前存在的一系列问题使其在临床治疗应用中遭遇瓶颈。问题的根源之一在于当前的基因编辑体系依赖于外源编辑酶或效应蛋白的表达,从而造成 (1) 蛋白分子量过大使得通过病毒载体进行装载及人体内递送十分困难;(2) 由蛋白过表达引起的DNA/RNA水平的脱靶效应;(3) 由外源蛋白表达引起的机体免疫反应及损伤;(4) 机体内的预存抗体使外源编辑酶或效应蛋白被中和从而导致基因编辑失败等。为解决上述问题,亟需建立新型基因编辑工具,特别是摆脱传统技术依赖于外源蛋白表达的桎梏。
ADAR (Adenosine deaminase acting on RNA) 是一类在人体内各组织中广泛表达的腺苷脱氨酶,能够催化RNA分子中腺苷A→肌苷I(鸟苷G)的转换。相比DNA编辑,RNA编辑不需要对基因组序列进行永久性改变,这种可逆的、易于调控的编辑方式在安全性上可能更具优势。麻省理工学院张锋课题组曾报道,过表达Cas13-ADAR融合蛋白及向导RNA可以实现靶向目标RNA的精准编辑 (Science 2017),但是该方法无法解决外源蛋白表达造成的问题。魏文胜课题组在研究中首次发现,只需转入一条特殊设计的RNA (arRNA, ADAR-recruiting RNA),就能够通过招募细胞内源的ADAR1 蛋白对靶向基因转录本上特定的腺苷产生高效精准的编辑,并不需要引入任何外源效应蛋白。ADAR1基因敲除与回补实验和高通量测序分析表明,细胞内源的ADAR1 蛋白介导了这一过程(图一)。这种新型RNA编辑技术被命名为LEAPER (Leveraging Endogenous ADAR for Programmable Editing on RNA)。
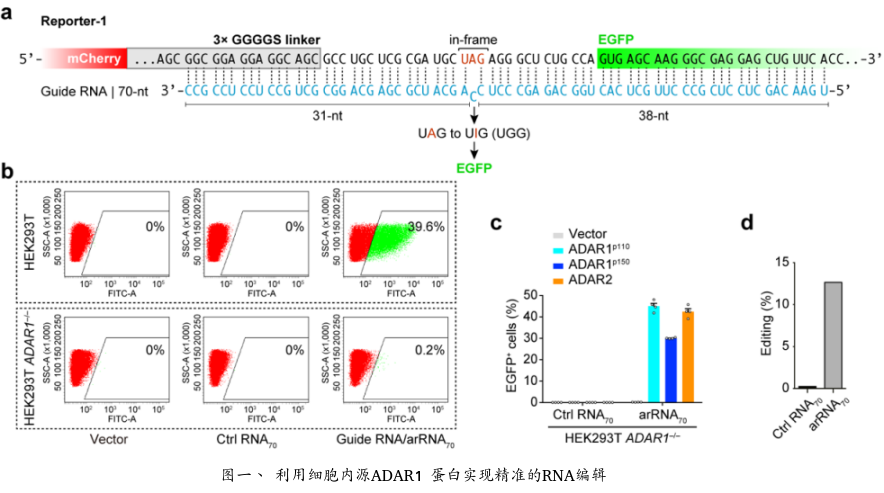
深入研究表明LEAPER具有广泛的适用性,能对RNA分子上绝大多数的腺苷酸位点进行精准编辑。在人的原代细胞-包括肺成纤维细胞、支气管上皮细胞及T细胞中,LEAPER的编辑效率最高可达80%,显示出该技术在疾病治疗中巨大的应用前景。在诸多应用尝试中,LEAPER的高效、精准的特性得到充分验证。比如LEAPER可以通过修复抑癌基因TP53中的致病突变来恢复p53突变体的转录调节功能。此外,在Hurler综合征患者来源的原代细胞中,LEAPER能够成功修复致病突变,并恢复细胞中的α-L-艾杜糖醛酸酶的催化活性(图二)。
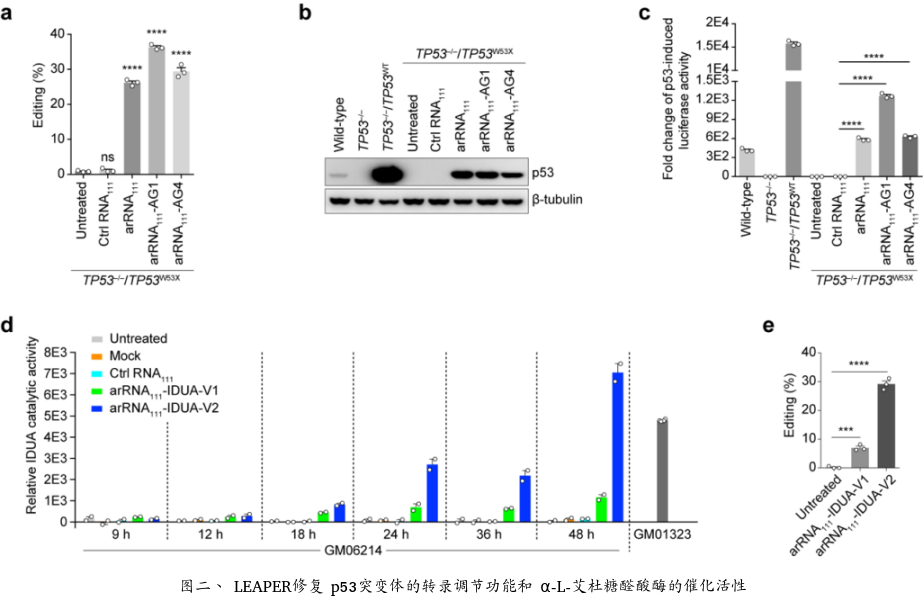
近期的研究表明,DNA单碱基编辑技术,包括胞嘧啶碱基编辑器和腺嘌呤碱基编辑器在RNA或DNA水平上产生了严重的脱靶现象 (Science 2019; Nature 2019),引发人们对其安全性的担忧。利用RNA-Seq技术在转录组水平对LEAPER技术进行的评估,没有观测到明显的脱靶现象,显示了新技术的高度特异性。另外,LEAPER不影响内源ADAR蛋白的正常功能,也不会激活细胞中的天然免疫反应,表明其是一类安全的基因编辑工具。
与RNAi类似,LEAPER充分利用了细胞中天然存在的机制:仅用一条RNA 就实现了精确高效的RNA单碱基编辑,从而避免了任何由于表达外源效应蛋白而引起的各种潜在问题。这种新型的基因编辑技术在科学研究和疾病治疗中显示出可观的优势与潜能,同时也为发展基于细胞内源机制的基因编辑技术指明了方向。近期,Thorsten Stafforst课题组报道了命名为RESTORE (recruiting endogenous ADAR to specific transcripts for oligonucleotide-mediated RNA editing) 的RNA编辑方法 (Nature Biotechnology 2019)。与LEAPER类似,RESTORE也能够利用内源ADAR进行靶向RNA的精准编辑;不同之处在于,RESTORE中的向导RNA是一段化学合成的寡核苷酸,为保持其稳定性,需要进行大量化学修饰。而LEAPER可以通过稳定表达的方式在细胞内发挥作用,因此适用于装载至腺相关病毒 (AAV)、慢病毒等载体中,在递送至机体后持续发挥功能。
北京大学魏文胜课题组博士生璩良 (PTN)、伊宗裔 (CLS)、王春慧 (BIOPIC)、曹中正 (CLS)、博士后朱诗优、副研究员周卓博士和博雅辑因生物科技有限公司袁鹏飞博士为该论文共同第一作者,魏文胜为该论文通讯作者。该研究项目得到了国家自然科学基金重点及面上项目、北京市科委生命科学前沿创新培育项目、北京未来基因诊断高精尖创新中心、北大-清华生命科学联合中心以及传染病防治国家科技重大专项的基金支持。
文章链接:https://www.nature.com/articles/s41587-019-0178-z
刘莹同学获评2019年北京市普通高等学校优秀毕业生
2019.07.10根据北京大学学工部〔2019〕4号《关于评选2019年“北京大学优秀毕业生”(夏季)和“北京市普通高等学校优秀毕业生”(夏季)的通知》的文件要求,通过材料审核、公开答辩等评定程序,刘莹同学(前沿交叉学科研究院)获评2019年“北京市普通高等学校优秀毕业生”和“北京大学优秀毕业生”称号。
刘莹同学通过自己的勤奋努力,在与同组同学的合作下,在多个课题研究领域获得了突破,并于2018年11月在Nature Biotechnology杂志在线发表了题为“Genome-wide screening for functional long noncoding RNAs in human cells by Cas9 targeting of splice sites”的研究论文,建立了长链非编码RNA的功能性筛选新方法。努力付出终于获得回报,刘莹同学于2019年7月顺利获得了博士学位,并以“北京市优秀毕业生”和“北京大学优秀毕业生”的身份光荣毕业。

祝贺本实验室郭生杰和刘莹同学获得博士学位
2019.07.10祝贺郭生杰和刘莹两位同学顺利通过博士学位答辩,获得博士学位!
追梦需要激情和理想,圆梦需要奋斗和奉献。祝福两位毕业的同学从此踏上新的人生征程,希望你们在奋斗中释放青春激情、追逐青春理想,以青春之我、奋斗之我,为民族复兴铺路架桥,为祖国建设添砖加瓦。

祝贺5位同学喜获2019-2020学年博士研究生“校长奖学金”
2019.07.05本实验的何苑、刘志恒、璩良、王春慧、张心怡五位同学获得2019-2020学年博士研究生“校长奖学金”。向他们表示热烈祝贺!
北京大学“校长奖学金”是学校设立的资助额度最大、影响范围最广,同时也是师生最关切、竞争最激烈的学术荣誉称号。申请者除了德智体美劳全面发展以外,还需要满足以下三个条件:第一,攻读博士研究生期间发表过较高水平的学术论文或论著等;第二,参加过国家重大课题研究并取得阶段性成果;第三,上一学年度专业成绩排名在前5%。
本次获奖的几位同学在课程学习、学术研究等方面均有突出表现,相信他们在今后的学习和科研中,将更好的发挥示范带动作用,鼓励本实验室的同学们更加专注学业精进,实现品学兼优、全面发展。
